En menos de seis meses, paciente recayó en consumo de fentanilo ilícito, tras cambiarse su medicación de marca por un genérico.
Un paciente de 56 años en dosis fija de Suboxone para trastorno por uso de sustancias comenzó a utilizar formulaciones genéricas desde mayo de 2019.
Inicio de tratamiento
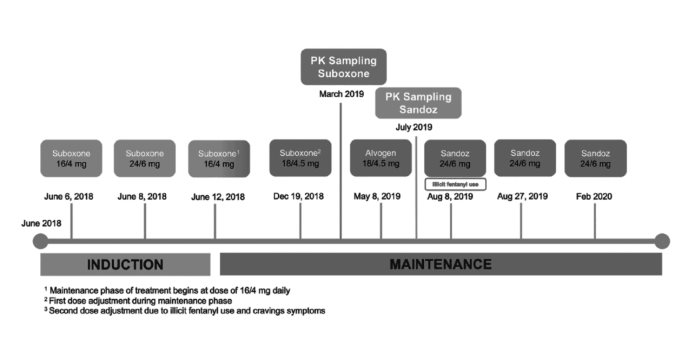
El 6 de junio de 2018, se inició el tratamiento de una paciente de 56 años de edad para trastorno por consumo de opioides (OUD, por sus siglas en inglés) en una clínica en Puerto Rico.
Además de los medicamentos que estaba tomando para tratar su trastorno por consumo de opioides, el paciente también estaba tomando: rosuvastatina de 10 mg diarios, ésteres etílicos de ácidos omega-3, 2 gramos BID, fenofibrato de 145 mg diarios y Triumeq (abacavir/dolutegravir/lamivudina, 600 mg/50 mg/300 mg). Además, estaba usando cannabis medicinal diariamente para el trastorno de ansiedad generalizada. No se realizaron cambios en la medicación mencionada a lo largo de su tratamiento en la clínica.
Sin embargo, el paciente comenzó el tratamiento con el medicamento Suboxone, buprenorfina/naloxona película sublingual, el 6 de junio de 2018, comenzando con una dosis inicial de 16/4 mg una vez al día. El paciente no experimentó ningún contratiempo importante durante los siguientes 6 meses, nunca faltó a una cita, no evidenció consumo de drogas ilícitas y no requirió ajustes de dosis.
En diciembre de 2018, el paciente informó haber experimentado síntomas de abstinencia asociados con síntomas depresivos pero sin consumo de drogas ilícitas, lo que llevó a su proveedor a ajustar la dosis de Suboxone (de 16/4 mg a 18/4,5 mg). El paciente permaneció sin más incidentes a partir de ese momento, con esta nueva dosis, durante los 6 meses siguientes hasta mayo de 2019.
Cambio de medicación obligatorio en Puerto Rico: marcas a genéricos
Con el cambio obligatorio de marca a genérico en abril de 2019 en Puerto Rico, al paciente se le cambió la formulación de Suboxone a medicamentos genéricos fabricados por Alvogen y Sandoz.
Primero se le recetó Alvogen, y durante una cita de seguimiento en la clínica, el 8 de mayo de 2019, informó sentir malestar y tener antojos de opioides, afirmando que la nueva medicación era menos eficaz para calmar sus síntomas, expresando sentimientos de desesperación y miedo a recaer en el consumo ilícito de opioides. En ese momento, no se realizaron ajustes de dosis.
Posteriormente, el 8 de agosto de 2019, los resultados toxicológicos rutinarios del paciente fueron positivos por fentanilo después de que el paciente informará que, durante el fin de semana, había experimentado síntomas intensos de abstinencia y había consumido fentanilo. Por lo tanto, la dosis de buprenorfina aumentó de 18/4,5 mg a 24/6 mg, diariamente.
El 27 de agosto de 2019, la paciente informó una mejoría en sus síntomas de abstinencia y antojos. También, que el mes anterior, se le había dispensado la formulación genérica producida por Sandoz., informando que además, en su experiencia, Sandoz provocaba menos síntomas adversos de abstinencia y antojos frente a Alvogen. Tras el aumento, el paciente permaneció estable hasta febrero de 2020, con la nueva dosis utilizando las láminas genéricas de Sandoz.
Estudio
Este paciente participó en un estudio farmacocinético de buprenorfina. Sus niveles plasmáticos de buprenorfina se midieron inicialmente antes del cambio de marca a genérico en marzo de 2019, y se repitieron los niveles tras el cambio a la formulación genérica de Sandoz en julio (antes de realizar cualquier cambio en la dosificación).
Durante un período de 8 horas, se recogieron muestras de sangre con la concentración más baja del medicamento antes de la dosis de la mañana. Cabe destacar que, aunque a el paciente se le prescribieron 18/4,5 mg una vez al día, declaró dividir sistemáticamente su dosis en 10/2,5 mg para la mañana y 8/2 mg para la noche.
La concentración mínima y el nivel plasmático se tomaron justo antes de la dosis, y las áreas bajo la curva se estimaron mediante regla trapezoidal en Microsoft Excel, versión 16.40.
La concentración máxima/concentración mínima de Suboxone fue más del doble que la del genérico. Además, tras la administración de la dosis, el tiempo hasta la concentración máxima de la formulación de marca fue más corto (1 hora) que el de la formulación genérica. El área bajo la curva de la buprenorfina y sus metabolitos indicó una mayor exposición de la formulación genérica en comparación con la de marca.
Discusión
Los diversos estudios que informaron sobre pacientes experimentando síntomas de abstinencia/ansiedad tras un cambio de formulación de buprenorfina se centraron principalmente en el cambio de película a comprimido. Sin embargo, se han realizado pocas observaciones clínicas documentadas del cambio de marca a película sublingual genérica.
Es interesante que en el paciente, los síntomas empeoraron cuando cambió a la formulación genérica, a pesar de que su exposición al fármaco activo aumentó. Una observación clínicamente importante de este caso, es el retraso en la concentración máxima de buprenorfina, concentración observada tras la ingestión de la formulación genérica, lo que puede indicar un inicio más gradual de la exposición al fármaco. Además, las diferencias entre los valores de la relación concentración máxima/mínima entre estas administraciones sugieren tasas de absorción diferentes.
La mayoría de los estudios que informan sobre el cambio de marca a medicamento genérico tampoco informan de alteraciones aparentes en el consumo de fármacos por parte de los pacientes tras el cambio. Sin embargo, estos estudios utilizaron un cambio de formulación flexible, que permitía a los pacientes volver a la original, con las justificaciones médicas adecuadas.
La paciente aquí descrita sí informó su uso de fentanilo después de haber sido obligada a utilizar la formulación genérica durante 3 meses. El médico tratante intentó varias veces convencer a los administradores del plan de salud que permitiera al paciente volver a tomar Suboxone, pero no lo consiguió. Este suceso supuso una interrupción de un tratamiento previamente establecido.
Esto concuerda con otros informes de aumentos de pruebas de orina positivas para drogas ilícitas, en pacientes estables que reciben buprenorfina genérica exigida por el seguro. Además, los pacientes se sienten infelices y ansiosos debido a la falta de control sobre su tratamiento.
Dado que este caso es el primero de este tipo informado en Puerto Rico, es importante que se desarrollen las evaluaciones clínicas adecuadas para la sustitución segura y eficaz de la formulación genérica.
Pese a que no se pueden elaborar recomendaciones clínicas generales basadas en la experiencia de este caso, es razonable que los pacientes que cambian de una formulación de marca a una genérica, deban ser informados primero sobre el cambio, y los ajustes en su psicoterapia ya que esto puede ayudarles a afrontar los posibles síntomas durante la transición antes de ajustar su dosis.