Hasta el día 29, no se registraron muertes en los pacientes que recibieron molnupiravir, en comparación con ocho muertes en los pacientes que recibieron placebo.
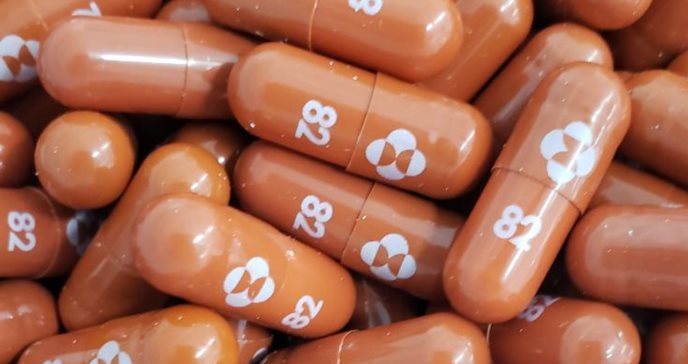
Merck informó este lunes que ha solicitado a la Administración de Alimentos y Medicamentos de EE.UU. (FDA, por sus siglas en inglés) una autorización de uso de emergencia para su tratamiento antiviral experimental contra el covid-19, el molnupiravir.
Si se concede la autorización, el fármaco, fabricado por Merck y Ridgeback Biotherapeutics, sería el primer tratamiento antiviral oral para combatir el covid-19. Se presenta en forma de cápsula.
Merck ha dicho que solicita la autorización de las cápsulas para tratar a los adultos infectados que corren el riesgo de evolucionar hacia la enfermedad grave del covid-19 o de ser hospitalizados. Su presentación se basa en un estudio que se detuvo en el punto intermedio porque el medicamento estaba funcionando muy bien en más de 700 pacientes asignados al azar para tomar molnupiravir o un placebo.
"En el análisis intermedio, molnupiravir redujo el riesgo de hospitalización o muerte en aproximadamente un 50%. El 7,3% de los pacientes que recibieron molnupiravir fueron hospitalizados o murieron hasta el día 29 después de la aleatorización, en comparación con el 14,1% de los pacientes tratados con placebo", dijo la compañía en un comunicado.
"Hasta el día 29, no se registraron muertes en los pacientes que recibieron molnupiravir, en comparación con ocho muertes en los pacientes que recibieron placebo". Ninguno de los voluntarios del ensayo había sido vacunado.
"El extraordinario impacto de esta pandemia exige que nos movamos con una urgencia sin precedentes, y eso es lo que han hecho nuestros equipos al presentar esta solicitud de molnupiravir a la FDA en los 10 días siguientes a la recepción de los datos", dijo el director general y presidente de Merck, Robert Davis, en el comunicado.
El tratamiento para el que busca autorización Merck
La dosis de molnupiravir es de cuatro píldoras de 200 mg del medicamento tomadas dos veces al día durante cinco días. Esto supone un total de 40 píldoras para un curso de tratamiento, de acuerdo a lo que informó la compañía.
"Merck ha estado produciendo molnupiravir en riesgo y espera producir 10 millones de tratamientos para finales de 2021, y se espera que se produzcan más cursos en 2022", dijo la compañía.
Ya ha vendido 1,7 millones de tratamientos al gobierno estadounidense. La empresa dijo que ofrecerá precios escalonados para facilitar el acceso en todo el mundo, y que trabajará con los fabricantes de medicamentos genéricos para acelerar la disponibilidad en los países de ingresos bajos y medios.
En una sesión informativa de covid-19 en la Casa Blanca, el Dr. Anthony Fauci, director del Instituto Nacional de Alergias y Enfermedades Infecciosas, calificó los resultados del ensayo de "muy alentadores", pero dijo que el medicamento debe ser examinado de cerca por la FDA.
Fuente CNNE