Un ensayo clínico pionero utiliza las tijeras moleculares contra la amiloidosis por transtiretina, una dolencia letal. La herramienta se aplica directamente en el torrente sanguíneo de pacientes.

El desarrollo de las herramientas basadas en CRISPR para editar el genoma les sirvió a las investigadoras Jennifer Doudna y Emmanuelle Charpentier para ganar el Premio Nobel de Química en 2020. Menos de un año después, se acaban de dar a conocer los primeros datos de un ensayo clínico que está usando esa misma tecnología para tratar una enfermedad rara y mortal inactivando el gen responsable. Con un añadido decisivo: por primera vez se ha usado inyectando la herramienta directamente en la sangre de los pacientes, lo que hace que pueda viajar por todo su cuerpo.
Los resultados son iniciales pero prometedores. Se presentaron conjuntamente en la revista New England Journal of Medicine y en la reunión internacional de la Sociedad de Nervio Periférico. Según Luis Querol, neurólogo en el Hospital Sant Pau de Barcelona y codirector del programa científico de la reunión, “fue la presentación estrella del congreso. Causó muchísima expectación, pero también cautela”.
Un tratamiento para toda la vida
La enfermedad en cuestión recibe el nombre de amiloidosis por transtiretina. Se produce por la acumulación de una proteína mal plegada que se va acumulando en diferentes lugares, como los nervios y el corazón. Y aunque su evolución es variable, la mayor parte de los pacientes muere entre 2 y 17 años después de recibir el diagnóstico.
Desde hace unos pocos años, sin embargo, existen tratamientos eficaces. “Su aparición fue un hito”, describe Querol, “pero también tienen inconvenientes. Algunos tienen efectos secundarios. Y en ciertos casos implican tener que administrarlos en el hospital de por vida cada tres semanas, preparando a los pacientes con corticoides cada una de esas veces”. Un tratamiento eficaz de edición genética implicaría actuar una sola vez para toda la vida.
“Hasta ahora, los ensayos clínicos con CRISPR se han hecho modificando células en el laboratorio para corregir ciertas formas de anemia y para tratar algunos tipos de cáncer mediante inmunoterapia”, explica Lluís Montoliu, investigador del Centro Nacional de Biotecnología del CSIC, presidente del Comité de Ética de esa misma institución y uno de los referentes sobre esta técnica en España. “También se ha probado para tratar un tipo de ceguera, la amaurosis congénita de Leber. Pero el ojo es un órgano muy especial que está muy aislado del resto del cuerpo. Inyectar la herramienta directamente en la sangre es otro cantar”.
La enfermedad escogida es un gran modelo de prueba. Por muchas razones, es una piedra de toque ideal y seguramente por eso la escogieron los investigadores. Para empezar, depende de un solo gen. Además, la proteína que la causa no es esencial para la vida y solo afecta al metabolismo de la vitamina A y de la tiroides.
“En principio, con dar suplementos de la vitamina y vigilar la función tiroidea es suficiente”, explica Querol. “Eso es lo que hacemos con los tratamientos actuales”. Y hay una ventaja añadida: el 99% de la proteína se produce en el hígado. Si se consigue dirigir la herramienta allí, se aumenta la eficacia limitando los posibles efectos secundarios. Eso es lo que han hecho.
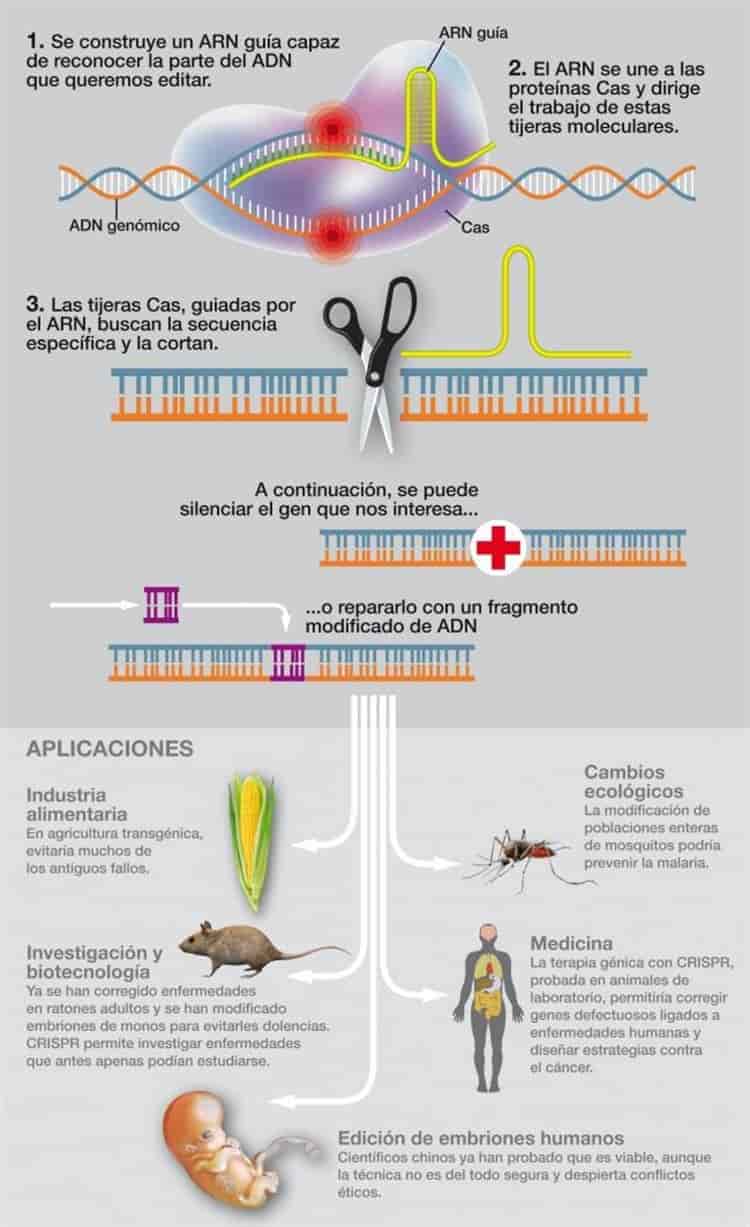
Infografía por: José Antonio Peñas, SINC
Cuidado con los mensajes triunfalistas
Otra cuestión que saltó en el congreso fue la posibilidad de que se alteraran los gametos, las células sexuales. Aunque hay formas hereditarias de la enfermedad, muchas no lo son. Si se inactivara el gen en ellas, la alteración artificial podría pasar a los descendientes. Y aunque el diseño está hecho para que la mayor parte del tratamiento haga su papel en el hígado, no se ha estudiado cuánto puede escapar de él. “Creo que la probabilidad de que suceda es baja”, afirma Montoliu, “pero desde luego no es imposible. Eso es algo que habrá que estudiar en modelos animales”.
La promotora del ensayo es la compañía Intellia, que se ha asociado con la farmacéutica Regeneron. Jennifer Doudna es cofundadora de la primera, cuyas acciones en los días posteriores al anuncio y la publicación subieron cerca de un 70 %. Tradicionalmente cauta, sus declaraciones a la revista Science son particularmente entusiastas: “Este es un primer paso fundamental para poder inactivar, reparar o reemplazar cualquier gen que cause una enfermedad, en cualquier parte del cuerpo".
Para Montoliu, ese mensaje “no está justificado con los datos actuales”. Actuar sobre otros lugares del cuerpo puede implicar diseños específicos que todavía no se han probado. Además, “hasta ahora lo que hemos aprovechado de CRISPR es su capacidad para inactivar genes, que es justo para lo que evolucionó la herramienta en las bacterias y en las arqueas, para defenderse de los virus que las amenazan cortando su ADN. Corregir los genes es más complicado y es algo que todavía no tenemos controlado”.
“Los resultados de este ensayo son desde luego prometedores, pero tampoco aquí hay que echar aún las campanas al vuelo”, añade. “Necesitamos ver su efecto en más pacientes y necesitamos seguir a estos pacientes durante más tiempo. Y eso es lo que se va a hacer”.
Fuente: SINC
Derechos: Creative Commons