Mieloma Múltiple (MM) es una malignidad de las células plasmáticas. El MM representa el 10% de las malignidades hematológicas y la edad promedio es alrededor de 65 años.
Según la Sociedad Americana del Cáncer, se estima alrededor de 35,730 casos para el 2023 en los Estados Unidos.
MM se caracteriza por la proliferación de las células plasmáticas, infiltrando la médula ósea. Esto produce una proteína anormal en la sangre y la orina, conocido como pico monoclonal o M-spike. Para diagnosticar MM se necesita múltiples laboratorios, una biopsia de médula ósea y de estudios radiológicos para detectar lesiones óseas o plasmacitoma. Los laboratorios más importantes son: electroforesis de proteína con inmunofluorescencia en suero y orina, niveles de cadena pesadas y ligeras en suero y colección de orina de 24 horas para proteínas. El MM se diagnostica al haber una proteína monoclonal en suero sobre 3 g/dL (pico monoclonal o M-spike) o una infiltración de células plasmáticas en la medula ósea mayor de 10%. El MM podría producir solamente cadenas ligeras de inmunoglobulina, que debido a su pequeño tamaño no se detectan como una proteína monoclonal en suero por la electroforesis, pero si midiendo sus niveles en suero o en una colección de orina. Estas se conocen como proteínas de Bence Jones.
Las características clínicas de MM son: lesiones osteolíticas sintomáticas, anemia, insuficiencia renal e hipercalcemia. Estos síntomas se conocen con el acrónimo ingles CRAB (Calcium, Renal Insuficiency, Anemia, Bone Lesions). En los pacientes de MM, tenemos algunos factores pronósticos como la edad, el estado de salud general, anomalidades genéticas y respuestas al tratamiento inicial. Esto nos ayuda a estratificar al paciente como de riesgo estándar o alto riesgo y de la misma manera nos puede ayudar a decidir que tratamiento recibirá el paciente
Originalmente solo se comenzaba tratamiento para el MM al tener síntomas (CRAB). Pero a través de los años se reconoció que hay algunos pacientes con MM asintomático que tienen un mayor riesgo a progresar y se benefician de tratamiento en el momento. Este grupo de pacientes se caracteriza por tener más de 60% de células plasmáticas en la medula ósea, cadenas ligeras de inmunoglobulina anormales>100 y presencia de alguna lesión ósea en MRI.
Tratamiento:
El tratamiento de MM se caracteriza por la terapia de inducción seguida por la consolidación con trasplante autólogo de células hematopoyéticos (TPH). Por lo tanto, al decidir el tratamiento inicial, es importante determinar si el paciente es candidato a trasplante. Anteriormente, la terapia de inducción consistía en esteroides en altas dosis y una combinación de quimioterapia. Pero a través de los años se ha expandido el tratamiento para los pacientes de MM y contamos con terapias inmunológicas, biológicas y moleculares que son igual de efectivas que la quimioterapia. Es importante destacar que, al escoger un tratamiento para el paciente, se debe escoger una combinación de tres drogas en vez de dos drogas, ya que sé que tiene más beneficio en la sobrevida.
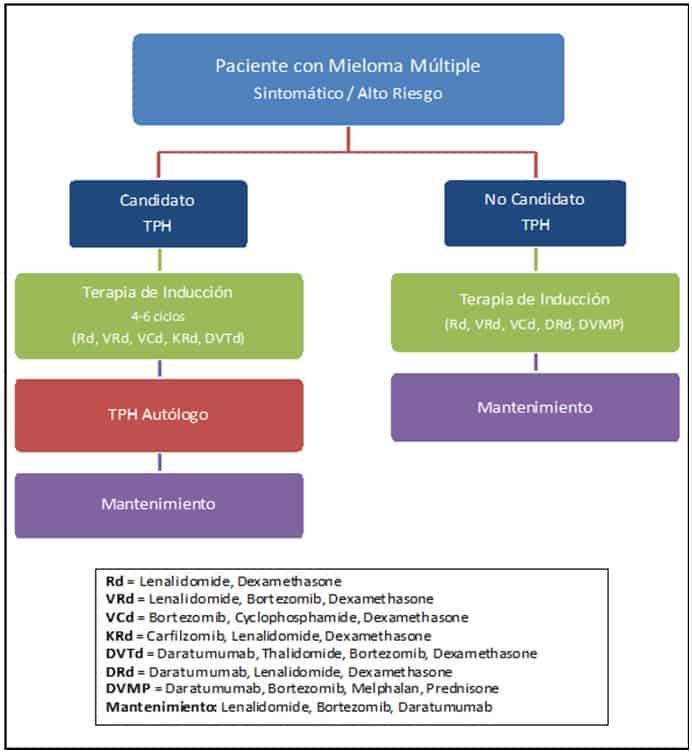
Entre las drogas más comunes están los Inhibidores de proteasoma. Estos bloquean la acción de las proteasomas, que están encargados en la descomposición de las proteínas. Esto puede evitar la degradación de factores pro-apoptoticos, que permite la activación de la muerte celular programada en células de cáncer. Esta clase de medicamento es de suma importancia para los pacientes con MM de alto riesgo. En esta clase están bortezomib, carfilzomib e ixazomib.
Los Agentes inmunomoduladores (IMiDs) se usan para mejorar la respuesta inmunitaria del cuerpo contra el cáncer. Estos son análogos a la talidomida y tienen múltiples mecanismos de acción como la apoptosis de las células tumorales malignas, la interferencia con las interacciones del tumor con el microambiente celular en la medula ósea entre otras. Entre ellos está la, lenalidomida y la pomalidomida.
Los Anticuerpos monoclonales (MoAb) han revolucionado el tratamiento de MM. Pueden actuar induciendo una citotoxicidad directa en la célula tumoral atreves de receptores o vías de señales celular. También trabajan al inducir una respuesta inmune en contra de las células tumorales. Los MoAb trabajan de forma eficiente con menos toxicidad que otras drogas. El primer MoAb aprobado para MM fue elotuzumab, anticuerpo en contra de SLAMF7 (Signaling Lymphocytic Activation Molecule family member 7). Esta droga trabaja al unirse a las células con la proteína SLAMF7 y las descompone. También actúa al activar el sistema inmune y mejora la capacidad de los linfocitos citolíticos (NK) naturales para atacar a las células cancerosa. Elotuzuma está aprobado en combinación con lenalidomida o pomalidomida junto a dexametasona para pacientes que han recibido 1 a 3 líneas de tratamiento previas.
Daratumuab e isatuximab son anticuerpos en contra de CD38. Estos tienen efectos antitumorales a través de citotoxicidad directa (ADCC, ADCP, CDC) y tiene efecto efectos directo sobre las células efectoras del sistema inmunológico. Es importante recalcar que estos dos MoAB se dirigen a distintos epítopos de CD 38. Isatuximab puede inducir directamente apoptosis, mientras que daratumuamb no puede inducir apoptosis sin combinarse con agentes reticulantes (cross-linking).
Selinexor es un inhibidor de la exportación nuclear. Inhibe la exportación de ciertas proteínas supresoras de tumores y reguladoras del crecimiento de tumores al bloquear la exportación 1. Esto conduce a un aumento en la supresión del tumor, lo que conduce a la muerte de las células cancerosas. Esta droga está aprobada en combinación con dexametasona o bortezomib en pacientes con MM en recaída o relapso que han recibido al menos 4 terapias previas.
Trasplante de Medula Ósea
El TPH sigue siendo un componente clave de la terapia del MM. Este se puede incorporar como parte de la terapia inicial o posponerse hasta la primera recaída. Aunque el TPH no es curativo, puede retrasar la progresión de la enfermedad. El escoger si el TPH se hace luego de la primera recaída o como terapia inicial es una decisión individualizada y se debe considerar algunos factores como la preferencia del paciente, edad, el tipo de riesgo de MM, respuesta a la terapia inicial, entre otras.
El TPH autólogo temprano da como resultado respuestas más profundas y una mejor sobrevida libre de enfermedad (PFS), aunque la sobrevida general (OS) no cambia mucho en comparación con el TPH tardío. Hay dos investigaciones grandes sobre TPH temprano versus tardío DETERMINATION y el IFM 2009. En ambos estudios, el TCH temprano dio como resultado respuestas más profundas con más respuestas completas y más pacientes que lograron un estado de MRD negativo. La PFS era más duradera, pero OS no era diferente entre TPH temprano versus tardío.
Una manera de prolongar la sobrevida libre de enfermedad luego de un TPH, es utilizar alguno de los fármacos como terapia de mantenimiento post trasplante. El mantenimiento se dar por dos años. Esto puede retrasar la progresión de la enfermedad y mejorar OS. Usualmente si el paciente es de riesgo estándar el
mantenimiento es con lenalidomida y si es MM de alto riesgo es una combinación de in inhibidor de proteosoma más lenalidomida.
En algunos casos donde el paciente sufre una recaída a un año y medio o más luego de un primer TPH autólogo y que responda un tratamiento de rescate pueden considerarse para un segundo TPH autólogo.
Terapias dirigida y CART
Con cada tratamiento de MM, es menos probable que el cáncer responda, y asi la enfermedad vuelve más rápido. Es por eso que el campo de la oncología y hematología sigue creciente y ahora tenemos nuevos tratamientos más específicas para el MM.
Las células de MM expresan una proteína llamada antígeno de maduración de célula B (BCMA), y esto a sido una estrategia para crear terapias dirigidas. Los dos tipos de terapias hechas para BCMA son los anticuerpos biespecificos (BiTe) y la terapia de CAR-T. Teclistamab es un BiTe que se une a dos antígenos diferente al mismo tiempo (BCMA y CD3). El CD3 es una proteína presente en las células T. Fue aprobado para pacientes que hayan usado al menos 4 terapias anteriormente incluyendo un anti-CD38, un inhibidor de proteosoma y IMiDs. Alguna de sus toxicidades son síndrome de liberación de citoquinas (CRS), toxicidad neurológica, hepatotoxicidad, infecciones y neutropenia.
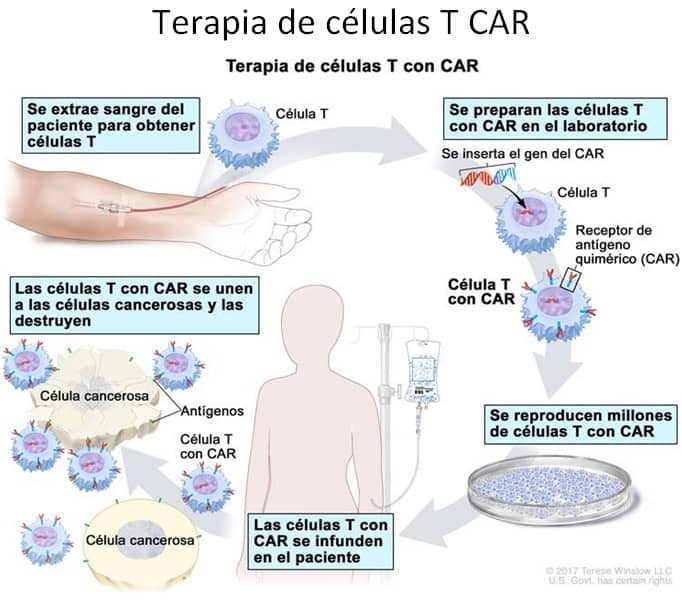
La terapia celular CAR-T es otra opción de tratamiento prometedora para el mieloma múltiple avanzado. El CAR-T para el MM es una forma de inmunoterapia que utiliza las células T genéticamente alteradas del propio paciente para reconocer y atacar las células cancerosas, específicamente dirigidas al receptor BCMA. Las células T del paciente se extraen del cuerpo y se modifican en un entorno de laboratorio para producir receptores especializados conocidos como receptores de antígenos quiméricos (CAR) en su superficie, que reconocen y se unen a antígenos específicos asociados al cáncer. Las células T alteradas se reintroducen en el paciente, donde pueden identificar y destruir eficazmente las células cancerosas. Los estudios han demostrado que la terapia CAR-T para el MM puede ser muy eficiente para controlar la progresión de la enfermedad e inducir una remisión completa en pacientes, que previamente no existía otra línea de tratamiento. Actualmente existen dos CAR-T aprobados por la Administración de Alimentos y Medicamentos (FDA); Idecabtagene vicleucel(ide-cel) y ciltacabtagene autoleucel(cilta-cel). Esto ofrece una posible nueva opción de tratamiento para los pacientes con MM más avanzado luego de recibir varias
líneas de tratamiento. Sin embargo, este tipo de terapia también puede conllevar un alto riesgo de efectos secundarios, entre ellos el CRS y toxicidad neurológica.
Conclusión:
Los recientes avances en el campo del MM han mejorado significativamente el pronóstico de los pacientes con dicha enfermedad considerada como una condición incurable. Como resultado, ahora se utilizan tratamientos como la inmunoterapia y nuevos agentes para ralentizar e incluso detener la progresión de la enfermedad. Además, los investigadores activamente estudian nuevas formas de mejorar aún más la eficacia del tratamiento, la calidad de vida y los resultados generales de los pacientes. Se trata del uso de agentes novedosos, una mejor comprensión de las vías moleculares y el desarrollo de terapias dirigidas. La introducción de estos nuevos tratamientos ha aportado una mayor sensación de esperanza a los pacientes con mieloma múltiple. Con la continuación de la investigación y de los ensayos clínicos, es probable que aún se produzcan más avances en este campo que conduzcan a nuevas mejoras en la atención a los pacientes. En definitiva, las perspectivas para los pacientes con mieloma múltiple son más halagadoras que nunca, con gran esperanza de mejores resultados en un futuro y potencial cura del MM. Con el tratamiento y los cuidados adecuados, los pacientes pueden vivir más tiempo y disfrutar de una mejor calidad de vida.
Reference:
1. Palumbo A, Anderson K, Multiple Myeloma Review Article N Egl J Med. 2011; 364:1046-1060
2. Krejcik J, Casneuf T, Nijhof IS, Verbist B, et al. Daratumumab depletes CD38+ immune regulatory cells, promotes T-cell expansion, and skews T-cell repertoire in multiple myeloma. Blood. 2016;128(3):384-94.
3. Richardson P, Jacobus, et al. Triplet Therapy, Transplantation and Maintenace until progression in Myeloma. N Engl J Med 2022; 387:137-147
4. Weiner LM, Murray JC, Shuptrine CW. Antibody based immunotherapy of cancer. Cell. 2012;148(6):1081-4.
5. Susanibar SP, et a. Chimeric antigen receptor T cell immunotherapy for multiple myeloma: Am J Hematol. 2019 May;94(S1): S28-S33.