Se utilizó una técnica llamada escaneo mutacional profundo para mapear los sitios alostéricos de este gen, presente en aproximadamente 1 de cada 10 cánceres.
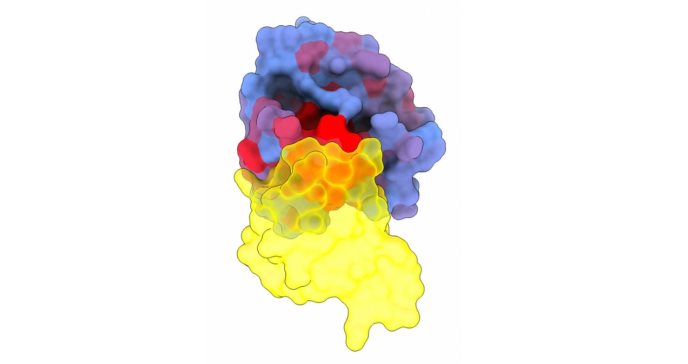
Un equipo compuesto por científicos del Centro de Regulación Genómica en Barcelona (CRG) y del Instituto Wellcome Sanger en Cambridge, Reino Unido, ha llevado a cabo una exhaustiva investigación de los sitios de control alostérico asociados a la proteína KRAS. Estos sitios se presentan como objetivos terapéuticos de gran valor para el desarrollo de fármacos, al representar vulnerabilidades ocultas que pueden ser aprovechadas para gestionar los efectos de una de las causas más significativas de la formación de tumores.
El estudio, que presenta el primer mapa completo de control obtenido hasta ahora para cualquier proteína, ha sido publicado hoy en la prestigiosa revista Nature. KRAS es uno de los genes más propensos a sufrir mutaciones en diversos tipos de cáncer, estando presente en aproximadamente uno de cada diez cánceres humanos. Su prevalencia es aún mayor en tipos más agresivos, como los cánceres de páncreas o pulmón.
La proteína generada por el gen KRAS ha sido comparada con la 'Estrella de la Muerte' del universo de 'Star Wars', debido a su forma esférica e impenetrable, caracterizada por la ausencia de un sitio adecuado en su superficie para ser regulada mediante fármacos. Debido a esta dificultad, KRAS ha sido considerada históricamente como 'inabordable' desde su descubrimiento en 1982.
La llave que regula la molécula KRAS
La única estrategia efectiva para controlar KRAS ha consistido en dirigirse a su sistema de comunicación alostérica, compuesto por señales moleculares que operan mediante un mecanismo de 'control remoto' de llave y cerradura. Para ejercer control sobre una proteína, es esencial contar con una llave (un compuesto químico o fármaco) capaz de abrir una cerradura (sitio activo). Las proteínas también pueden ser reguladas mediante una cerradura secundaria (sitio alostérico) ubicada en otra parte de su superficie.
Cuando una molécula se une a un sitio alostérico, desencadena un cambio en la forma de la proteína, lo que puede modificar su actividad o su capacidad para unirse a otras moléculas. Por ejemplo, este cambio puede alterar la estructura interna de la cerradura principal.
Para el desarrollo de fármacos, los sitios alostéricos son preferidos debido a su mayor especificidad, lo que reduce la probabilidad de efectos secundarios. Además, ofrecen la posibilidad de modificar la actividad de una proteína de manera más sutil, permitiendo un ajuste más preciso de su función mediante un control inteligente. En comparación con los fármacos dirigidos a sitios activos, aquellos que se centran en sitios alostéricos tienden a ser más seguros y efectivos.
A pesar de estas ventajas, la detección de sitios alostéricos representa un desafío. A lo largo de cuatro décadas de investigación, con decenas de miles de publicaciones científicas y más de 300 estructuras publicadas de KRAS, solo dos fármacos, sotorasib y adagrasib, han sido aprobados para uso clínico. Estos fármacos operan al unirse a una cavidad adyacente al sitio activo, provocando un cambio conformacional alostérico en la proteína que inhibe su activación.
Dianas prometedoras y proteínas completas
André Faure, experto en el Centro de Regulación Genómica (CRG) y coautor del estudio, destaca la complejidad del proceso: "Llevó décadas desarrollar un fármaco efectivo contra KRAS, en parte debido a la falta de herramientas para identificar sitios alostéricos a gran escala, lo que implicaba la búsqueda a ciegas de dianas terapéuticas. En este estudio, presentamos un nuevo enfoque para mapear sistemáticamente sitios alostéricos en proteínas completas. Para el descubrimiento de fármacos, es como encender las luces y revelar las múltiples formas en que podemos controlar una proteína".
El estudio utilizó una técnica llamada escaneo mutacional profundo para mapear los sitios alostéricos. Se generaron más de 26,000 variantes de la proteína KRAS, alterando uno o dos aminoácidos a la vez. El equipo evaluó cómo estas variantes se unían a otras seis proteínas, incluyendo aquellas cruciales para la iniciación del cáncer por KRAS. La análisis de los datos se llevó a cabo utilizando software de inteligencia artificial, lo que permitió identificar tanto sitios alostéricos conocidos como nuevos y su relevancia terapéutica.
Mutaciones para la función de KRAS
"El punto fuerte de nuestro método es su escalabilidad. En este trabajo hemos realizado más de 22.000 mediciones biofísicas, un número comparable con el total hecho para todas las proteínas antes de que se pudieran aprovechar los avances en metodologías de secuenciación y síntesis de ADN. Esto es una aceleración enorme y demuestra el poder y potencial de nuestro método", expone Chenchun Weng, primer autor del estudio e investigador postdoctoral en el CRG.
La técnica empleada ha revelado que KRAS cuenta con una cantidad considerablemente mayor de sitios alostéricos de lo inicialmente anticipado. Mutaciones en estos sitios afectan interacciones cruciales para la función de KRAS, indicando la posibilidad de inhibir de manera amplia su actividad. Algunos de estos sitios alostéricos, distribuidos en cuatro cavidades distintas, resultan especialmente intrigantes debido a su fácil accesibilidad en la superficie de la proteína, convirtiéndolos en dianas terapéuticas prometedoras para futuros fármacos. Entre ellos, la 'cavidad 3' destaca como particularmente interesante, al encontrarse lejos del sitio activo de KRAS y haber recibido escasa atención por parte de la industria farmacéutica.
KRAS y su papel en el cáncer
Los investigadores también observaron que pequeñas modificaciones en KRAS pueden tener un impacto significativo en sus interacciones, llevando a la preferencia de ciertas interacciones sobre otras. Este hallazgo es relevante, ya que podría abrir la puerta al desarrollo de nuevas estrategias para controlar la actividad anómala de KRAS sin comprometer su función normal en tejidos no cancerosos. La preservación de las variantes normales de KRAS conlleva menos efectos secundarios y posibilita tratamientos más seguros y efectivos. Esta información también podría arrojar luz sobre el comportamiento de KRAS en distintos contextos, siendo crucial para comprender su papel en diversos tipos de cáncer.
Este estudio representa el primer mapeo completo de sitios alostéricos para una proteína completa. Demuestra que, con las herramientas y técnicas adecuadas, como las utilizadas para cartografiar KRAS, es posible descubrir nuevas vulnerabilidades y modular numerosas proteínas con relevancia clínica, incluso aquellas que históricamente se consideraban 'inabordables'. "El gran desafío en medicina no radica en identificar qué proteínas desencadenan enfermedades, sino en descubrir lo que desconocemos y cómo controlarlo. Nuestra investigación plantea una nueva estrategia para abordar estas proteínas y acelerar el desarrollo de fármacos para regular su actividad. La orientación de fármacos hacia sitios alostéricos sugiere que es probable que sean más seguros y efectivos que los disponibles en la actualidad", concluye Ben Lehner, profesor de investigación ICREA y autor principal del estudio.
Fuente consultada aquí.